A tüskefehérje hatása a mitokondriumokra; HBO2 terápia hatása az amiloidfibrinekre és egy jó hír: a rendszeres testmozgás mérsékelheti és akár megakadályozhatja az amiloidózis kialakulását
| Angelika Mihalik |
Parsifaler (1, 2) és Spartacus írása és több tanulmány felhasználásával.
Összefoglalás:
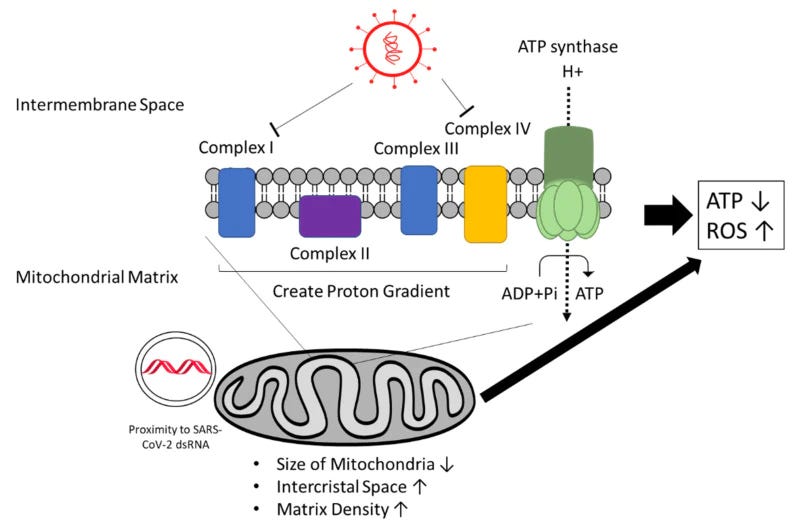
- A SARS-CoV2 víruson kívül egyetlen más vírusnak sincs ilyen erős hatása a mitokondriumokra. A tüskefehérje nagyon erős affinitással rendelkezik a mitokondriális mátrixhoz. Ez az, ahonnan képes gátolni a Complex IV1 működését.
- A tüskefehérje egy, a ciánmérgezéshez hasonló mérgezést is előidéz.
- Ez magyarázatot ad a Covid véralvadási zavarra, a fibrózisra, az amiloidózisra, a hipoxiára és, ami a legfontosabb, a hosszú COVID-ra.
- A HBO2 kezelés egy aerob szünetet biztosít a szervezet számára a megfelelő aerob anyagcseréhez, enyhítve ezzel a fennálló oxigénhiányt.
- A SARS-Cov2 tüskefehérje megzavarja a hem-molekulák normális kötődését, ezért megzavarja az oxigénellátást. Ez a funkcionális hipoxia hasonló a CO- és a cianidmérgezéshez, amelyek során a HBO2 terápia szokásosan alkalmazásra kerül.
- A tüskefehérje mérgezés (Covid19 és/vagy génterápiás injekció okozta károsodás) ellen a legjobb módszer a rendszeres testmozgás és a kiegyensúlyozott, antioxidánsokban gazdag, endotheltámogató étrend, különösen a D-vitaminban, étrendi nitrátban, szelénben és más, az endothel egészségét támogató oxidánsokban gazdag étrend.
- A rendszeres testmozgás mérsékli a tüskefehérje amyloidogén hatásait is. Eszerint a tanulmány szerint a rendszeres testmozgás 47%-os csökkenést eredményezett a preamyloid oligomer szintekben, és a Covid-19 megbetegedés esetén 100%-os túléléssel járt együtt.
- Az intenzív testmozgás azonban a különböző etiológiájú, tünetmentes szívbetegségek esetén hirtelen szívhalállal járhat, ezért mindenképpen klinikai kivizsgálás szükséges a megkezdése előtt.
1. Tüskefehérje és mitokondriumok
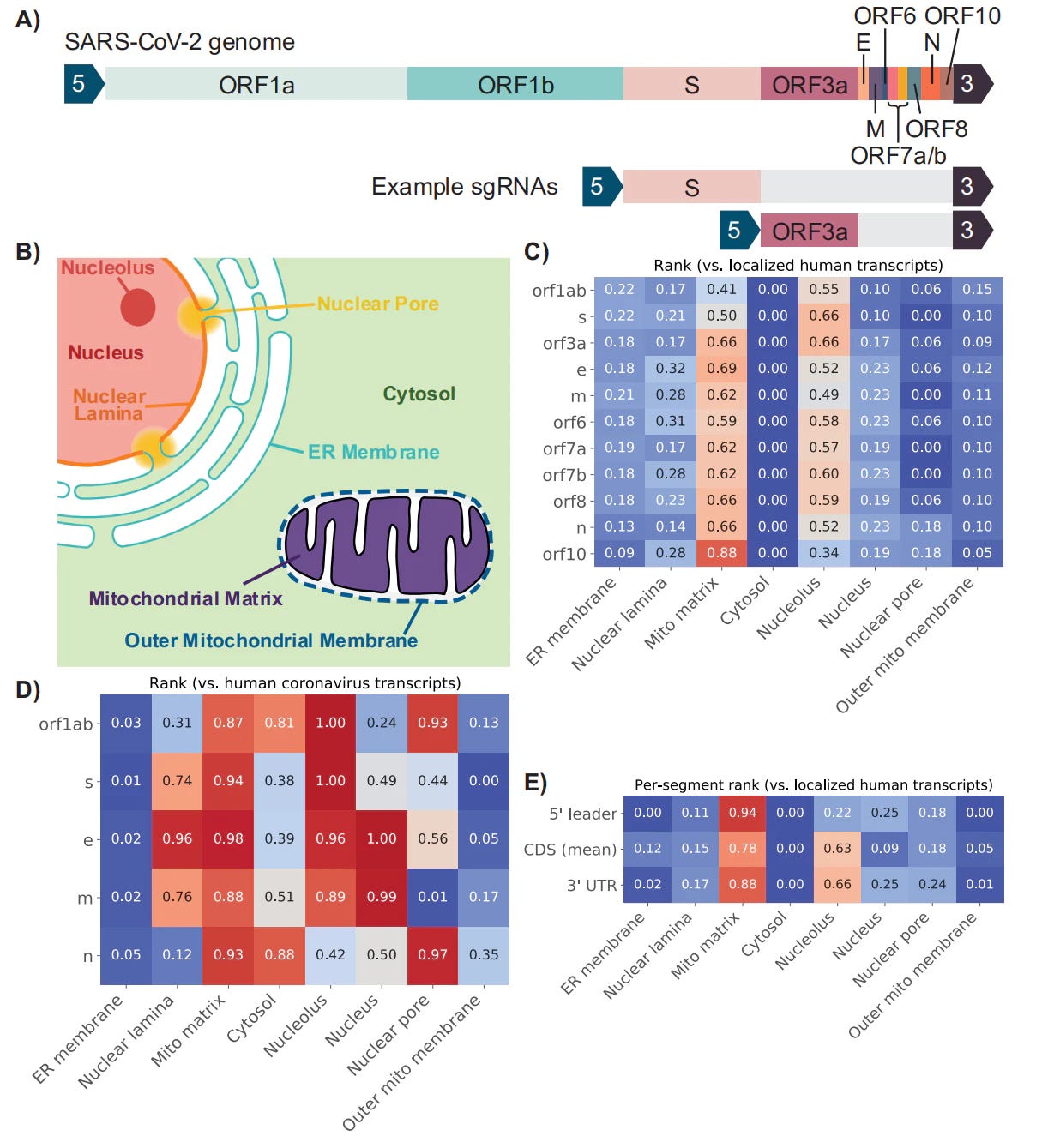
A tüskefehérje és a mitokondriumok közötti kölcsönhatások folyamatos elemzése és vizsgálata megdöbbentő eredménnyel járt. 2020 júniusában publikáltak egy tanulmányt, amelyben azt feltételezték, hogy a COVID19-nek hívott megbetegedést a mitokondriumokkal való virálisinterferenciával2 is elő lehet idézni.
Azt is felfedezték, hogy a vírus gátolja a IV-es elektrontranszportlánc-komplexet. Konkrétan megfigyelhető volt a vírusfehérjék kölcsönhatása az I. és IV. komplex más komponenseivel, ami az RC-komplex kiegyensúlyozatlan aktivitásához és ROS-termelődéshez is vezethet.
Egyetlen más vírusnak sincs ilyen erős hatása a mitokondriumokra. Mindezt egy RNS-GPS-elemzéssel sikerült bebizonyítani, amely előre jelezte, hogy a SARS-CoV-2 genomja hová lokalizálódhat. A tüskefehérje nagyon erős affinitással rendelkezik a mitokondriális mátrixhoz. Ez az, ahonnan képes gátolni a Complex IV működését.
Ezek után a már említett kórképeken túl érhet még minket meglepetés?
Nézzük.
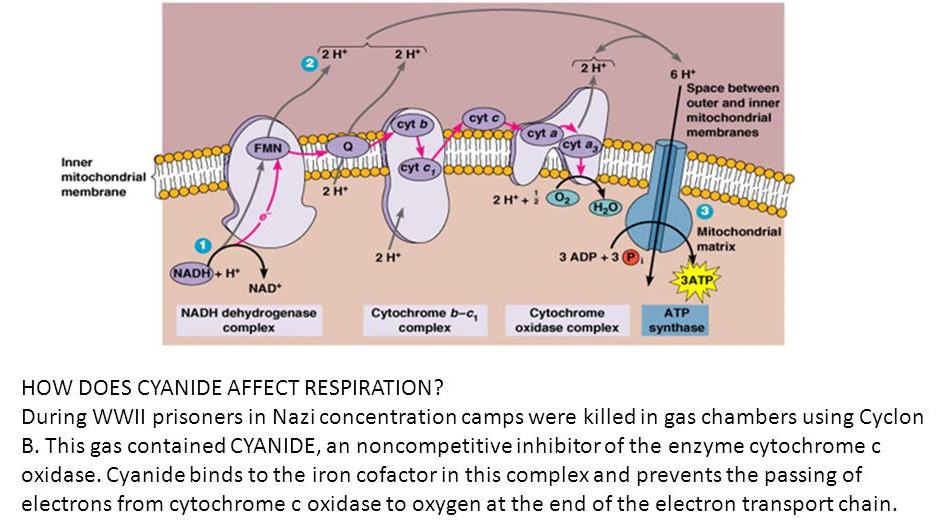
2. Tüskefehérje és ciánA Zyklon-B-t a németek tömeges népirtásra használták a második világháborúban. A Zyklon-B egy hidrogén-cianid méreg.
A második világháború alatt a náci koncentrációs táborokban a foglyokat gázkamrákban ölték meg, ciklon B-vel. Ez a gáz cianidot tartalmazott, amely a citokróm c oxidáz enzim nem kompetitív gátlója. A cianid a komplexben lévő vas kofaktorokhoz kötődik, és megakadályozza az elektronok átadását a citokróm c oxidázból az oxigénhez az elektrontranszportlánc végén.
A cianid kötődik a vas kofaktorhoz a hem-tartalmú fehérjékben. Ez gátolja az elektrontranszportlánc IV. terminális citokrómkomplexének működését. A IV. komplexnek a cianid által történő blokkolása kimeríti az ATP-t, ami a sejthalált okozza. Az oxigén nem képes a redukált citokróm a3 újraoxidálására.
Ez a COVID-19 és a hosszú COVID esetében is megfelel az amiloidózis feltevésnek. Az amiloid-B pontosan ugyanilyen módon gátolja az elektrontranszportlánc komplexét.
Mivel az akut cianidmérgezés a rendkívül oxigénérzékeny központi ideg- és szív- és érrendszer mellett több szervrendszerre is hatással lehet, a kezdeti klinikai tünetek gyakran nem specifikusak és nem egyértelműek, mint például fejfájás, hányinger, hányás, szorongás, nyugtalanság és zavartság. Súlyos mérgezések esetén a bágyadtság, a görcsrohamok és a kóma a központi idegrendszer mérgezettségének lehetséges megnyilvánulásai. Míg a súlyos kardiovaszkuláris toxicitásra jellemző a hypotensio és a cianózist eredményező bradycardia végső állapota, a vizsgáló orvosok a hemodinamikai zavart megelőzően rövid ideig tachycardia és hipertónia tüneteivel találkozhatnak a katekolaminok által közvetített reflexes kompenzációs folyamatok miatt.
Nyugodtan állíthatjuk, hogy a tüskefehérje egy aeroszolos, erősen fertőző "Zyklon-B".
Ez magyarázatot ad a Covid véralvadási zavarra, a fibrózisra, az amiloidózisra, a hipoxiára és, ami a legfontosabb, a hosszú COVID-ra. A tüskefehérje egy, a ciánmérgezéshez hasonló mérgezést is előídéz.
3. HBO2 terápia alkalmazása súlyos Covid19 megbetegedésbenAzt állapítja meg, hogy a HBO2 kezelés egy aerob szünetet biztosít a szervezet számára a megfelelő aerob anyagcseréhez, enyhítve ezzel a fennálló oxigénhiányt.
A SARS-Cov2 tüskefehérje megzavarja a hem-molekulák normális kötődését, ezért megzavarja az oxigénellátást. Ez a funkcionális hipoxia hasonló a CO- és a cianidmérgezéshez, amelyek során a HBO2 terápia alkalmazás szokott történni.
Bevezetés
Ez egy konferenciahívás összefoglalója, amely a túlnyomásos oxigénnel foglalkozó szervezet meghívott tagjai között került megrendezésre. A résztvevők között voltak az Amerikai Sürgősségi Orvosok Kollégiumának tenger alatti és túlnyomásos orvoslással foglalkozó tagjai, valamint a túlnyomásos oxigénterápiával (HBO2) és a COVID19 megbetegedéssel kapcsolatos klinikai vizsgálatokkal foglalkozó kutatók. A megbeszélésről készült felvétel alapján összeállított szinopszis.
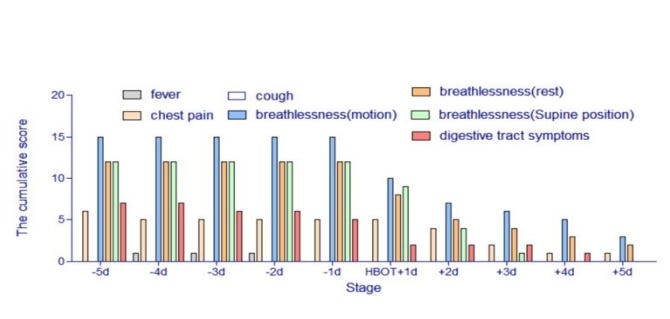
5 esettanulmányt ismertettek, amely során a SARS-CoV2-vel megfertőzött, kovidos tüdőgyulladásban is szenvedő betegeknél minden más gyógymódra tett kísérlet kudarcot vallott, és minden egyes beteg állapota rohamosan romlott. Az első kezelésnél a betegek 90 percig, majd azt követően 60 percig kaptak HBO2 kezelést.
Eredmények:
Klinikai tünetek: 1. A láz nem volt tartós tünet; 2. Mindig megszűnt egy rutinterápiás kúra után; 3. A köhögés nem volt kiemelkedő tünet ezekben az esetekben; 4. A kezelést megelőzően jelenlévő súlyos légszomj tünet már az első HBO2 kezelést követően "nyilvánvalóan enyhültek"; 5. A légszomj (fekvő helyzetben) három nappal később megszűnt; 6. Emésztőrendszeri tünetek öt nappal később megszűntek; 7. Az enyhe mozgás közbeni légszomj kivételével minden tünet alapvetően enyhült.
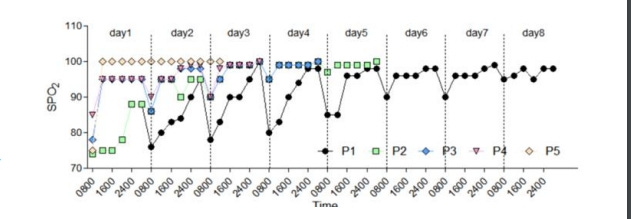
Diagnosztikai változások: 1. Minden beteg SpO2-értéke napról napra emelkedett; 2. A betegeket a kórteremből a kamrába oxigénes lélegeztetés nélkül szállították át; 3. A kamrán kívüli SpO2-érték tükrözi a hypoxémia valódi mértékét a természetes légzés állapotában; 5. A HBO2 előtti vs. utáni SpO2-érték naponta javulást mutatnak a HBO2 alkalmazása után.
ABG: 1. A PaO2 és a SaO2 szignifikánsan emelkedett a HBO2 kezelések után (P<0,05); 2. A PaCO2 nem szignifikáns emelkedése arra utal, hogy a betegeknél a HBO2 bevezetése előtt a túllélegeztetés nem hatékony oxigénfelvétellel járt együtt; 3. A HBO2 előtti emelkedett laktátszint a szisztémás anaerob anyagcserének tulajdonítható a progresszív hypoxia miatt.
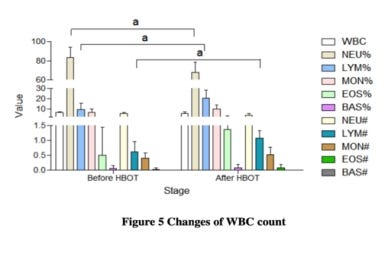
CBC: 1. A közelmúltban megjelent COVID-19 megbetegedéssel kapcsolatos tanulmány szerint azoknál, akik nem élték túl a betegséget jelentősen csökkent a limfociták száma; 2. Az egyes betegek limfocita- és LYM%-a láthatóan emelkedett a HBO2-kezelések után; 3. Arra enged következtetni, hogy a napi HBO2 rutinszerű, szisztematikus adagolása csökkentené a mortalitást
Véralvadási zavarok: 1. A fibrinogén (FIB) a HBO2 előtt megnövekedett, és jelentősen csökkent a HBO2-kezelés után (P<0,05), csakúgy, mint a D-Dimer (D-D); 2. Az aktivált parciális tromboplasztin ideje (APTT) a kezelés után láthatóan megemelkedett.
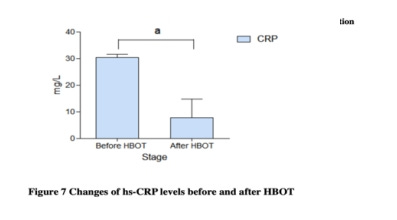
Gyulladásos markerek: 1. A megnövekedett plazma CRP-koncentrációról a COVID-19 megfigyelt klinikai jellemzőjeként számoltak be; 2. A CRP csökkent a HBO2 után.
3. CT-lelet: 1. Minden esetben korábban mindkét tüdőben nagy sűrűségű tömör árnyékokat mutattak ki képalkotó vizsgálatok; 2. Az összes HBO2 alatt vagy után készült mellkas CT felvételen szignifikánsan 3. A mellkasi CT-képalkotás azt sugallta, hogy a COVID-19 tüdőgyulladás fő patológiai elváltozása az alveolusok gyulladása volt. 4. A betegeknél a tüdő gázcsere-funkciója nagyobb mértékben károsodott, mint a légzésfunkció; 5. Csökkent PaO2 csökkent vagy normális PaCO2-vel társult.
Következtetések:
- Feltételezhető, hogy az HBO2 megfelelő aerob anyagcserét biztosított a szervezet számára, enyhítve az oxigénhiányt;
- Két HBO2-kezelés elegendő lehet a legtöbb súlyos COVID19-es beteg hypoxiájának megszüntetéséhez;
- Ezt követően a napi HBO2-kezelés alapvetően elkerülhetővé teszi a COVID9 tüdőgyulladásos betegek hipoxémiáját, ha a SpO2 70%-nál alacsonyabb;
- A HBO2 döntő fontosságú a súlyos és kritikus állapotú, COVID-19 pneumóniában szenvedő betegek kezelésében;
- Azt feltételezzük, hogy a korai kiegészítő HBO2 megállíthatja a beteg állapotának romlását azokban az esetekben, amikor a maszkos oxigénlégzés nem tudja megakadályozni a beteg állapotának romlását és az SpO2 csökkenését;
- A napi HBO2 rutinszerű hozzáadása csökkentené a mortalitást.
Megjegyzések és észrevételek;
- A túlnyomásos kezelés kiválasztási kritériumai nincsenek meghatározva;
- A kamrában történő O2-adagolás módszere nincs leírva;
- Említést tesznek a nagy áramlású oxigén használatáról hagyományos nem légzéskönnyítő készülékeken keresztül, ami nem tekinthető klasszikus HBO2 alkalmazásnak;
- Azt az elképzelést, hogy a rövid ideig tartó HBO2 alkalmazása az oxigénellátás hosszan tartó javulását eredményezi, nem támasztják alá a más körülmények között szerzett tapasztalatok, ahol a PO2 a dekompressziót követően perceken belül lecsökkent;
- Az esetsorozatban a laktátszint csökkenése statisztikailag szignifikáns volt, de klinikailag nem volt jelentős (csak minimálisan emelkedett a HBO2 előtt). Maga a laktát nem sokat mond a hipoxiáról, mivel az emelkedésnek számos oka lehet;
- A COVID-19 fertőzés általános mortalitása kevesebb mint 1%, és a szokásos lefolyás klinikai javulás. Tehát egy kisebb betegcsoport megfigyelése esetén nehéz következtetni, hiszen ez akár lehetett volna a szokásos betegség lefolyás is;
- Nagyobb tanulmány/több olyan esetleírás szükséges, amelyből következtetések vonhatóak le a halálozással és/vagy a HBO2 lehetséges terápiás előnyeivel kapcsolatban;
- Felmerül a kérdés, hogy szükséges-e állatkísérleteket végezni, mivel ez az esetsorozat már kimutatta, hogy a kezelés sikeres volt az embereken.
- Bár ez az esetsorozat nem mutatott olyan szintű bizonyítékot, amely alapján a COVID-19-es betegeket HBO2-vel kellene kezelni, ez egy nagyobb, szervezett, jól protokollált és jól megtervezett vizsgálatot indokol;
Ez az esettanulmány megvalósíthatósági tanulmánynak tekinthető. A HBO2-t sikeresen alkalmazták a COVID-19-es betegek kezelésére, és a betegek állapota nem romlott akut módon a kamrában. Az a kérdés, hogy a HBO2 ezeknél a betegeknél tüdőödémát idézne-e elő, ebben az esetsorozatban nem merült fel.
Oxigénszint
PROs
- A COVID-19 megzavarja a hem-molekulák normális kötését, ezért megzavarja az oxigénellátást. Ez a funkcionális hipoxia hasonló a szénmonoxid- és a cianidmérgezéshez, amelyek esetében a HBO2 alkalmazása indikált.
- A COVID-19 által okozott tüdőkárosodásban szenvedő betegek gyakran súlyos hipoxémiával és felhalmozott oxigénadóssággal jelentkeznek, amelyeknél a HBO2 enyhülést hozhat.
- A túlnyomásos oxigén valószínűleg megemeli az artériás PO2-t arra a viszonylag rövid időre, amíg a HBO2 reálisan alkalmazható.
CONs
Az artériás és szöveti PO2 a hiperbár expozíció végén gyorsan visszaesik az alapértékre; így a vér és a szövetek oxigénellátásának növekedése csak ideiglenes lehet.
4. A rendszeres testmozgás a SARS-CoV-2 és annak tüskefehérjéje káros hatásait orvosolhatja - így akár csökkentheti az oltáskárosodáskat isA nefrilizin blokkolhatja a tüskefehérje amiloidogén tulajdonságait.
A tüskefehérje mérgezés (Covid19 és/vagy génterápiás injekció okozta károsodás) ellen a legjobb módszer a rendszeres testmozgás és a kiegyensúlyozott, antioxidánsokban gazdag, endotheltámogató étrend, különösen a D-vitaminban, étrendi nitrátban, szelénben és más, az endothel egészségét támogató oxidánsokban gazdag étrend.
A rendszeres testmozgás mérsékli a tüskefehérje amyloidogén hatásait is. Eszerint a tanulmány szerint a rendszeres testmozgás 47%-os csökkenést eredményezett a preamyloid oligomer szintekben, és ez 100%-os túléléssel járt együtt.
Bizonyos körülmények között a testmozgás egyértelműen előnyös, és egy hipertrófiás kardiomiopátiás egérsérletben, amelynél az egerek a szívizomzat myozin nehézláncát kódoló gén mutációját hordozták, az egerek kerékben történő futtatása megakadályozta a szívpatológia kialakulását, és amikor idősebb állatoknál elkezdték a futattást alkalmazni, javított az állapoptukon. Az intenzív testmozgás azonban a különböző etiológiájú, tünetmentes szívbetegségek esetén hirtelen szívhalállal járhat.
Klinikai vizsgálatokat kell végezni hosszú COVID-ban szenvedő, és génterápiával oltott, ezáltal nagy tüskefehérje expozíciónak kitett betegek részvételével, neprilizin felhasználásával. A neprilizin, más néven neutrális endopeptidáz (EC3.4.24.11), egy a szervezetben széles körben elterjedt cinkfüggő metallopeptidáz, amely aktívan lebontja a különböző peptideket az immunrendszerben, a keringési rendszerben és az idegrendszerben. A neprilizin genetikai hiánya az amiloid-β felhalmozódását eredményezi az agyban.
A testmozgás visszafordítja a preamyloid oligomert és meghosszabbítja a túlélést αB-krisztallin-alapú desmin-alapú kardiomiopátiában.
1Az elektrontranszportlánc IV. komplexe, más néven citokróm-c-oxidáz egy több egységből álló struktúra, amely a citokróm-c-ból származó elektronokat az oxigénhez juttatja, és a folyamat során víz képződik, valamint hozzájárul a protongradiens létrehozásához. A citokróm c oxidáz két hem-csoportot, az úgynevezett hem A-t és hem A-3-at, valamint három réziont tartalmaz. A rézionok közül kettő egy CuA/CuA elnevezésű közeget alkot, míg a harmadik rézatomot CuB-nek nevezik. A CuB a hem A-3-mal társulva segít az oxigén vízzé történő redukciójában. Összesen négy redukált citokróm c molekula kötődik egymás után a IV-es komplexhez, és mindegyikük egy-egy elektront ad le. Az első elektron a CuA/CuA központra, majd a hem A-ra, aztán a hem A-3-ra és végül a CuB-re kerül. Ezáltal a CuB a +2 állapotból a +1 állapotba redukálódik. A második elektron a hem A-3-hoz vándorol és redukálja azt. Amikor ez a két csoport teljesen redukált állapotba kerül, megkötnek egy oxigénmolekulát a hem A-3 és a CuB közötti peroxidhídról. Mindkét csoport további két elektront vesz fel, és két (a mátrixból származó) proton megkötésével a peroxidhíd a CuB-OH és a hem A3-OH csoportoktól elszakad. További két proton felvételekor a mátrixból két vízmolekula szabadul fel, és a CuB és a Hem A-3 csoportok visszaoxidálódnak eredeti állapotukba. Az elektronmozgás során a IV. komplex összesen négy protont pumpál ki a mátrixból a membránközi térbe.
2„A világszerte zajló világjárvány miatt a SARS-CoV-2 által kiváltott COVID-19 mögött meghúzódó mechanizmusok intenzív vizsgálat tárgyát képezik. A SARS-CoV-1 vírusról rendelkezésre álló adatok alapján azt feltételezzük, hogy a CoV-2 RNS-transzkriptumok mitokondriumokban történő lokalizációja révén eltéríti a gazdasejt mitokondriális funkcióját a vírus előnyére. A vírus RNS-transzkriptumok mellett az RNS is lokalizálódik a mitokondriumokban. A SARS-CoV-2 közvetett módon manipulálja a mitokondriális funkciót, először a mitokondriális funkció ACE2 szabályozásával, és amint bejut a gazdasejtbe, akkor az olyan nyitott olvasatkeretek (ORF), mint az ORF-9b, közvetlenül manipulálhatják a mitokondriális funkciót, hogy kikerüljék a gazdasejt immunitását, és megkönnyítsék a vírus replikációját és a COVID-19 betegség kialakulását. A gazdaszervezet mitokondriumainak vírusos ORF-ek általi befolyásolása képes a mitokondriális DNS-t (mtDNS) a citoplazmában felszabadítani és aktiválni az mtDNS-indukált inflammaszómát, valamint elnyomni a veleszületett és adaptív immunitást. Azt állítjuk, hogy az ACE2 működésének csökkenése az idősödő egyénekben, párosulva a mitokondriális funkciók korral összefüggő hanyatlásával, amelynek eredményeként krónikus anyagcserezavarok, például cukorbetegség vagy rák alakulnak ki, a gazdatestet sebezhetőbbé teheti a fertőzésekkel és az egészségügyi szövődményekkel és a halálozással szemben. Ezek a megfigyelések arra utalnak, hogy a vírus RNS és a fehérjék különböző lokalizációjának a mitokondriumokban alapvető szerepet kell játszania a SARS-CoV-2 patogenezisében. A vírus és a gazdaszervezet mitokondriumai közötti kommunikáció hátterében álló mechanizmusok megértése létfontosságú információkat nyújthat a COVID-19 patológiáiról. A mitokondriumok SARS-CoV-2 általi eltérítésének vizsgálata a COVID-19 megelőzésére és kezelésére irányuló új megközelítésekhez vezethet."
When you subscribe to the blog, we will send you an e-mail when there are new updates on the site so you wouldn't miss them.